Lasten lääkehoidon edistäminen
Lapset ja nuoret kuuluvat ikäryhmään, jota lääketeollisuus ei ole riittävästi ottanut huomioon uusien lääkkeiden kehitystyössä.
Lääkkeitä käytetään lapsilla suurelta osin kokemusperäisesti aikuisista kerättyjen tietojen perusteella ilman erityisiä lapsille suoritettuja tutkimuksia tai tutkimustiedon pohjalta, joka on peräisin muilta tahoilta kuin lääkkeen alkuperäiseltä kehittäjältä. Lasten lääkehoidossa käytetään myös lääkemuotoja, joita ei ole suunniteltu lasten tarpeisiin.
Euroopan komissio julkaisi vuonna 2007 lastenlääkeasetuksen, jonka keskeinen tavoite on lisätä tutkittujen ja lapsille soveltuvien lääkkeiden saatavuutta. Asetuksen myötä kaikilla Euroopan markkinoille tulevilla uusilla lääkkeillä on oltava Euroopan lääkeviraston kanssa sovittu lastenlääkkeen kehitysohjelma, jollei tähän ole jotain perusteltua syytä.
Fimea on vuodesta 2004 ollut aktiivisesti mukana vaikuttamassa lastenlääkkeiden kehitykseen muun muassa osallistumalla asetuksen sisällön luonnosteluun sekä antamalla tieteellistä neuvontaa Euroopan lääkeviraston lastenlääkekomiteassa ja rokotetyöryhmässä.
Lastenlääkeasetuksen tavoitteena on
- edistää uusien lääkkeiden ja sopivien (lapsiystävällisten) lääkemuotojen kehittämistä lasten lääkehoitoon
- varmistaa, että lasten lääkehoitoon käytettävät lääkkeet perustuvat korkeatasoiseen tutkimukseen ja lupamenettelyyn
- kuitenkin samalla välttää turhia tai liiallisia lapsille tehtäviä kliinisiä kokeita sekä
- lisätä ja parantaa käytettävissä olevaa tietoa lääkkeiden vaikutuksista lapsiin.
Euroopan komission 10-vuotisraportti lastenlääkeasetuksen toiminnasta

EU-komissio julkaisi lokakuussa 2017 raportin lastenlääkeasetuksen vaikutuksista kymmenen vuoden ajalta. Raportissa todetaan, että lastenlääkeasetuksella on ollut selkeä positiivinen vaikutus. Asetuksen myötä lastenlääkkeiden kehityksestä on tullut kiinteä osa normaalia lääkekehitystä.
Vuosien 2007 ja 2016 välisenä aikana lapsille on saatu yli 260 uutta lääkettä, joko aivan uusina myyntilupina tai uusina käyttöaiheina.

Parhaiten asetuksen vaikutukset näkyvät terapia-alueilla, joissa lääkkeitä kehitetään myös aikuisille. Uusia lääkkeitä lapsille on saatu erityisesti reuman, infektioiden ja sydänsairauksien hoitoon sekä rokotteisiin.

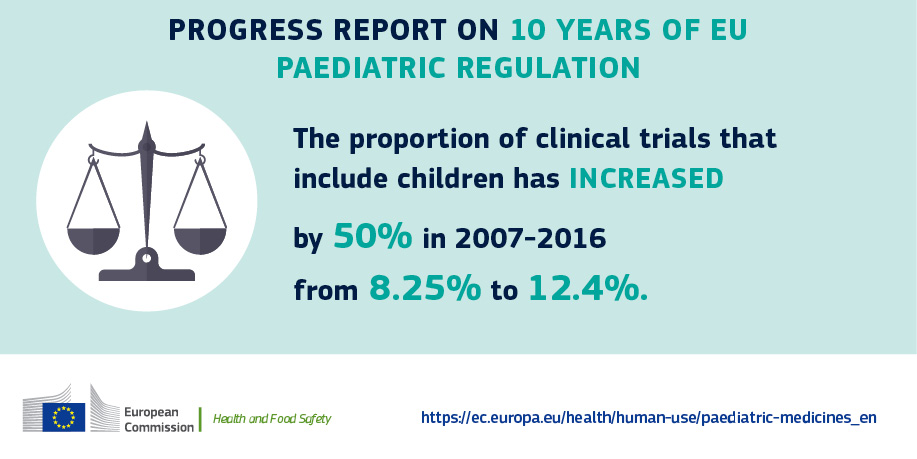
Asetuksen vaikutukset ovat heikompia pelkästään lapsilla esiintyvien sairauksien kohdalla sekä sairauksissa, joissa taudinkuva on aikuisista poikkeava. Lisääntynyt lastenlääkkeiden kehittäminen näkyy myös siinä, että lapset osallistuvat yhä useammin kliinisiin lääketutkimuksiin. Lasten kliiniset tutkimukset muodostavat Euroopassa nyt 12,4 prosenttia kaikista tutkimuksista, kun ennen asetusta vastaava luku oli 8,25 prosenttia.
Asetuksessa käytettyjen velvoitteiden ja kannustimien todetaan pääosin toimivan tarkoituksen mukaisesti. Patenttivapaille lääkkeille tarkoitettu palkkiojärjestelmä lastenlääkkeen kehittämiseksi ei ole kuitenkaan tuottanut toivottua tulosta (PUMA; Paediatric Use Marketing Authorisations).
Ennen kuin mahdollisista lastenlääkeasetuksen muutoksista tehdään ehdotuksia, komissio aikoo tehdä kokonaisarvioinnin lastenlääkkeiden ja harvinaissairauksien kehittämistä säätelevien asetusten toiminnasta ja yhteisvaikutuksista. Lisäksi EU-komissio ja Lastenlääkekomitea aikovat edistää asetuksen toimeenpanoa ja ohjeistusta sekä eri tahojen kansainvälistä yhteistyötä.
Lue lisää
- Lasten lääkkeiden myyntiluvat
- Artikkeli ”Lääkettä lapselle – käytännön niksit puntarissa”
- Euroopan Komission lastenlääkesivut
- Euroopan Lääkeviraston lastenlääkesivut
- Kansallinen lastenlääkkeiden tutkimusverkosto
- Euroopan Lääkeviraston lastenlääkekomitea
- EU-komission raportti lastenlääkeasetuksesta “State of Paediatric Medicines in the EU - 10 years of the EU Paediatric Regulation”