Kooste koronarokotteiden haittavaikutusilmoituksista
Päivitetty 7.3.2024
Tässä koosteraportissa julkaistaan tietoja Fimeaan tulleista koronarokotteiden haittavaikutusilmoituksista. Haittavaikutusilmoitukset kuvastavat tapahtumia, jotka on havaittu rokottamisen jälkeen, mutta eivät välttämättä liity rokotteeseen. Haittavaikutusilmoitukset kuvastavat ilmoittajan havaintoja ja näkemyksiä, eivätkä tarkoita sitä, että rokotteen ja havaittujen vaikutusten välinen yhteys olisi vahvistettu. Jos jatkuvan turvallisuusseurannan ja tieteellisen arvioinnin jälkeen rokotteeseen liitetään uusi haittavaikutus tai turvallisuusongelma, ryhdytään toimenpiteisiin esimerkiksi tuotetietojen ja rokotusohjeiden päivittämiseksi (kts. alla ’Koronarotteiden tuotetietoihin lisättävät haittavaikutukset’).
Koronarokotteiden haittavaikutusilmoitusten vakavuusarvio perustuu ilmoittajan arvioon, tai jos sitä ei ole ilmoitettu, Fimean arvioon. Fimea voi nostaa, mutta ei laskea ilmoittajan vakavuusarviota. Haittavaikutus tulisi arvioida vakavaksi, jos se on: johtanut kuolemaan, hengenvaaraan, sairaalahoitoon tai sen pidentymiseen, aiheuttanut pysyvän vamman, toimintakyvyn laskun tai synnynnäisen epämuodostuman.
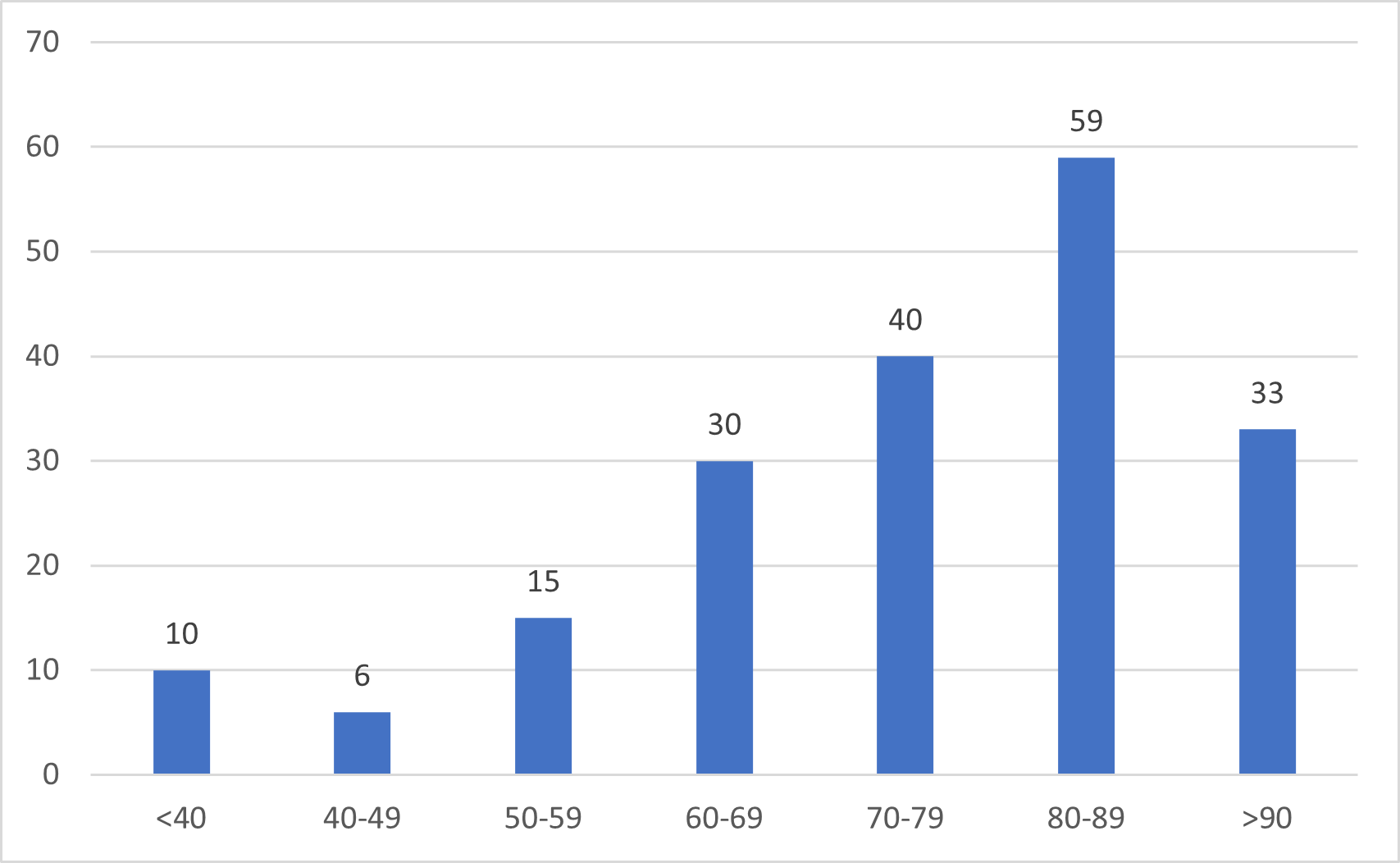
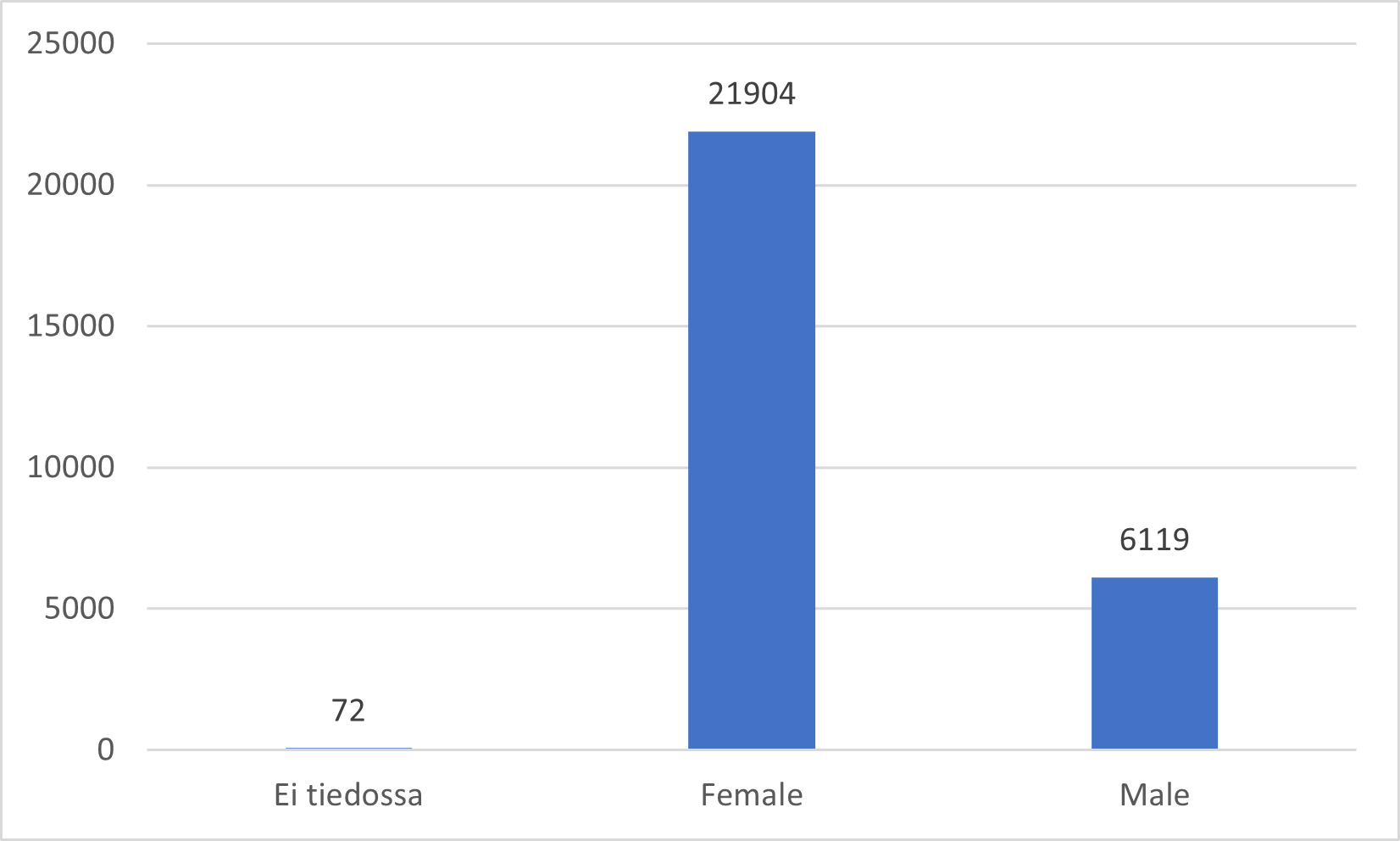
Fimeassa 7.3.2024 mennessä käsitellyt koronarokotteiden haittavaikutusilmoitukset ovat koskeneet mRNA-rokotteita Comirnatya ja Spikevaxia (mukaan lukien varianttirokotteet), adenovirusvektorirokotteita Vaxzevriaa ja Jcovdenia sekä proteiinirokote Nuvaxovidia. Ilmoitukset ovat painottuneet työikäisiin rokotettuihin ja useimmiten on ilmoitettu rokotteiden tunnettuja haittavaikutuksia, kuten kuumetta, päänsärkyä, väsymystä, raajakipua, lihaskipua, nivelkipua ja rokotuskohdan kipua.
Koronarokotteiden haittavaikutusilmoitukset Fimean haittavaikutusrekisterissä
Käsiteltyjen ilmoitusten lukumäärä: tilanne 7.3.2024
| Rokotetyyppi (kauppanimi) | Ilmoitusten kokonaismäärä** | Ei-vakavat ilmoitukset** | Vakavat ilmoitukset*,** |
|---|---|---|---|
| mRNA-rokote Comirnaty (ml varianttirokotteet) | 19809 | 14825 | 4984 |
| mRNA-rokote Spikevax (Moderna) | 5675 | 4571 | 1104 |
| Adenovirusvektorirokote Vaxzevria (AstraZeneca) | 2973 | 2060 | 913 |
| Adenovirusvektorirokote Jcovden (Janssen) | 14 | 9 | 5 |
| Proteiinirokote Nuvaxovid (Novavax) | 27 | 18 | 9 |
| Yhteensä | 28498 | 21483 | 7015 |
* Vakavuusarvio perustuu ilmoittajan arvioon, tai jos sitä ei ole ilmoitettu, Fimean arvioon. Fimea voi nostaa, mutta ei laskea ilmoittajan vakavuusarviota. Haittavaikutus arvioidaan vakavaksi, jos se on: johtanut kuolemaan, hengenvaaraan, sairaalahoitoon tai sen pidentymiseen, aiheuttanut pysyvän vamman, toimintakyvyn laskun tai synnynnäisen epämuodostuman.
** Kokonaislukumäärä voi olla vähemmän kuin eri rokotteiden summa, koska yhdessä ilmoituksessa voi olla epäiltynä useampia eri koronarokotevalmisteita.
Koronarokoteilmoituksille vuoden 2021 aikana muodostunut käsittelyjono on purettu, eikä ilmoituksia ole enää käsittelyjonossa. Kaikki ilmoitukset käsitellään viipymättä niiden saavuttua Fimeaan.
Ilmoitusten vakavuusarvio vaikuttaa ensisijaisesti ilmoitusten käsittelyn kiireellisyyteen ja tietojenvaihdon nopeuteen Fimean, Euroopan lääkeviraston EudraVigilance-tietokannan ja rokotteen myyntiluvan haltijan välillä. Haittavaikutusilmoituksia ja niistä mahdollisesti nousevia signaaleja priorisoidaan ja arvioidaan lääketieteellisin perustein, ei pelkästään ilmoitetun vakavuuden perusteella.
Suomessa eri valmistajien koronarokotteita on käytössä eri määriä. Niistä rokotteista, joita annetaan eniten, tulee myös eniten ilmoituksia. Haittavaikutusilmoitusten lukumäärän perusteella ei voi vertailla eri rokotteiden turvallisuutta keskenään. Tietoa rokotusten etenemisestä löytyy THL:n verkkosivuilta.
Haittavaikutusilmoitukset kuvastavat ilmoittajan havaintoja ja näkemyksiä, eivätkä tarkoita sitä, että rokotteen ja havaittujen vaikutusten välinen mahdollinen yhteys olisi vahvistettu. Rokotteen hyödystä ja riskeistä voidaan tehdä päätelmiä vasta, kun kaikki käytettävissä olevat tiedot ovat läpikäyneet tieteellisen arvioinnin osana rokotteen jatkuvaa turvallisuusseurantaa. Jos turvallisuusongelma tieteellisen arvioinnin jälkeen varmistuu, ryhdytään toimenpiteisiin esimerkiksi tuotetietojen ja rokotusohjeiden päivittämiseksi.
Ilmoitetut haittavaikutukset
Koronarokotteiden ilmoitetut haittavaikutukset on listattu rokotekohtaisesti.
Rokotekohtaisissa tiedostoissa tarkastellaan kaavioiden ja taulukoiden avulla rokotteen kaikkia ja vakavaksi ilmoitettuja haittavaikutuksia. Taulukoissa on esitetty elinryhmittäin yleisimmin ilmoitetut haittavaikutukset.
Yksi ilmoitus sisältää keskimäärin viisi epäiltyä haittavaikutusta, joten ilmoitettujen haittojen määrä on suurempi kuin ilmoitusten määrä. Yhdessä ilmoituksessa voidaan kuvata rokotteen jälkeen ilmenneen esimerkiksi nokkosihottumaa, pahoinvointia ja päänsärkyä, jolloin yhdessä ilmoituksessa on kolme haittaa.